| 일 | 월 | 화 | 수 | 목 | 금 | 토 |
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | |||
| 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 19 | 20 | 21 | 22 | 23 | 24 | 25 |
| 26 | 27 | 28 | 29 | 30 | 31 |
- 자동차 안전장치
- 세포간 커뮤니케이션
- 유전자 조열
- 단백질
- 자동차 분석
- 세포 교류과정
- 에어컨 구성요소
- 엔진구성요소
- 캠축
- 암의 변환
- 크랭크.
- 돌연변이 세포
- 세포
- 배아세포
- 자동차분석
- start 세포
- 브레이크 종류
- 세포주기
- 조절실
- 차축
- 세포 교류
- 효소
- 세포 전달
- 밸프
- 세포의 성장
- 연로라인
- 박테리아
- 암 발생원인
- 에어콘 구성요소
- 유전자 서열
- Today
- Total
면역 항암제 및 자동차 분석글
효소의 구조 및 활성화 방안 본문
효소의 구조 및 활성화 방안
2020. 6. 17. 07:25효소의 구조 및 활성화 조건
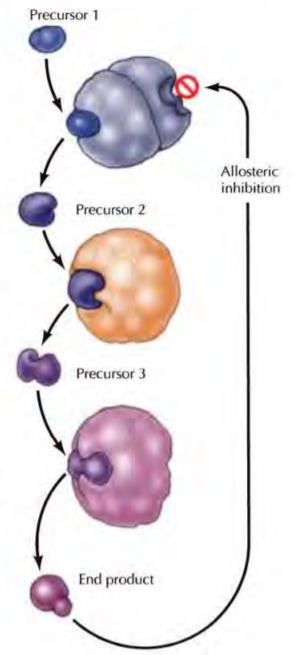
작은 분자에의 한 조절 대부분 효소는 입체 구조의 변화로 조절되고 촉매 활성을 변화시킵니다. 이러한 입체 구조 변화는 효소 활성을 조절하는 아미노산 오를 뉴클레오타이드와 같은 작은 분자의 결합에서 비롯된다. 이러한 유형의 조절은 일반적으로 피드백 억제를 통해 대사 경로를 조절하는 역할을 합니다.
예를 들어, 많은 생합성 경로(아미노산)의 최종 생성물은 합성의 첫 번째 단계를 촉매하는 효소를 억제하고, 과다한 양의 합성을 방지하면서 제품의 적절한 공급을 보장합니다. 피드백 억제는 알레르기 분자가 촉매 부위와 다른 효소 상의 부위에 결합하는 알로스테릭 조절의 한 예이다.
이러한 조절분자의 결합은 단백질의 입체 구조를 변화시켜 촉매 부위의 형상을 변화시켜 촉매 활성에 영향을 미칩니다. 많은 전사 인자(디스크 세단 7장) 또한 작은 분자의 결합으로 조절됩니다. 예를 들어, 락토스를 대장균의 리프래 서에 결합하면 리프래서가 DNA를 결합하는 것을 방지하는 입체 구조 변화를 유도합니다.
진핵 세포에서 스테로이드 호르몬은 유사하게 전사 조절 단백질에 결합하여 유전자 발현을 조절합니다. GTP 결합에 의한 eEFla와 같은 번역 인자의 조절은 세포 내 단백질의 활성을 조절하는 또 다른 공통 메커니즘을 나타냅니다. 이 경우 단백질의 GTP 결합 형태는 활성 형태이며 GOP 결합 형태는 비활성입니다.
많은 세포 단백질은 GTP 또는 GOP 결합으로 유사하게 조절됩니다. 이 단백질은 세포 증식자의 TICN과 비인간 암의 제어에서 역할을 위해 집중적으로 연구된 RAS 암 유전자 단백질을 포함합니다. 이러한 단백질의 X-ray 결정학은 특히 흥미롭고, 불활성 GOP 결합 유형과 활성 GTP 결합 유형 사이의 미묘하지만, 기능적으로 매우 중요한 입체 좌표 차이를 보여줍니다. 이 단백질 구조의 작은 차이는 RAS(활성 GTP 결합 형태)가 표적 분자와 상호 작용할 수 있는지를 결정하고, 이는 세포가 분열되도록 신호를 보냅니다. 가스 유전자의 돌연변이가 인간 암의 약 20%의 발생에 이바지한다는 사실에 의해, 단백질 입체 구조에서 그러한 미묘한 차이의 중요성이 극적으로 나타났습니다.
돌연변이는 활성 GTP 결합 입체 구조와 연속적으로 신호 세포 분열에 갇혀 암세포의 제어되지 않는 증식을 주도하기 위해 RAS 단백질의 구조를 변화시킵니다. 대조적으로, 정상적인 RAS 단백질은 GTP와 GOP 결합 입체 구조 사이에서 교대로, 일반적으로 세포 프로를 조절하는 호르몬과 성장 인자에의 한 자극에 의해서만 활성됩니다.
단백질 인산화 전 절에서 논의된 예는 단백질과 작은 분자 억제제 또는 활성화제와의 비 공유 결합을 포함합니다. 무고요 결합이 형성되기 때문에 이러한 조절 분자의 단백질에 대한 결합은 쉽게 가역적이며 세포가 환경 변화에 신속하게 반응할 수 있게 합니다. 그러나 많은 단백질의 활성은 공유 결합 변형으로 조절됩니다.
이러한 유형의 조절 예는 비활성 전구체의 단백질 분해 절단에의 한 일부 효소의 활성화됩니다. 이 CH-pater에서 이전에 지적했듯이, 혈액 응고에 관여하는 소화 효소 및 단백질은 이 메커니즘에 의해 조절됩니다. 그러나 단백질 분해는 돌이킬 수 없어서 환경 변화에 반응하여 단백질을 켜고 끄는 대신 효소 활성화를 제어하는 수단을 제공합니다.
'면역 항암제' 카테고리의 다른 글
| 세포로서의 단백질의 역할과 운반 과정 (0) | 2020.06.17 |
|---|---|
| ER의 역할과 특징 (0) | 2020.06.17 |
| 글리코 실화 의미 및 변화 과정 (0) | 2020.06.17 |
| 샤페온 및 단백질 성형의 개념과 특징 (0) | 2020.06.17 |
| mRNA의 개념 (0) | 2020.06.17 |




