| 일 | 월 | 화 | 수 | 목 | 금 | 토 |
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | ||||
| 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 |
| 18 | 19 | 20 | 21 | 22 | 23 | 24 |
| 25 | 26 | 27 | 28 | 29 | 30 | 31 |
- 유전자 서열
- 세포
- 브레이크 종류
- 암의 변환
- 세포의 성장
- 에어콘 구성요소
- 연로라인
- 크랭크.
- 차축
- 돌연변이 세포
- 세포간 커뮤니케이션
- 에어컨 구성요소
- 단백질
- 박테리아
- 캠축
- 자동차분석
- 조절실
- 유전자 조열
- 세포 교류
- 자동차 분석
- start 세포
- 엔진구성요소
- 자동차 안전장치
- 효소
- 배아세포
- 세포 전달
- 밸프
- 암 발생원인
- 세포 교류과정
- 세포주기
- Today
- Total
면역 항암제 및 자동차 분석글
단백질 인산화 개념 및 특징 소개 본문
단백질 인산화 개념 및 특징 소개
2020. 7. 3. 10:55단백질 인산화 개념 및 특징 소개
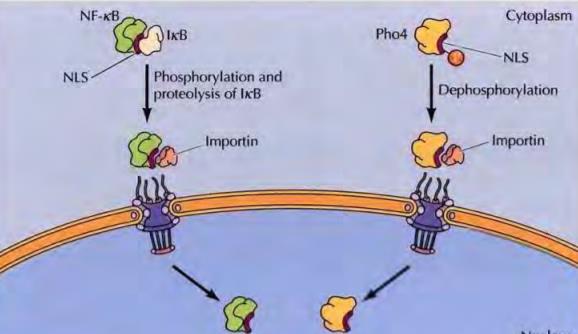
단백질 인산화는 단백질과 작은 분자 억제제 또는 활성화제와의 비 공유 결합을 포함합니다. 무고요 결합이 형성되기 때문에 이러한 조절 분자의 단백질에 대한 결합은 쉽게 가역적이며 세포가 환경 변화에 신속하게 반응할 수 있게 합니다. 그러나 많은 단백질의 활성은 공유 결합 변형으로 조절됩니다.
이러한 유형의 조절 예는 비활성 전구체의 단백질 분해 절단에의 한 일부 효소의 활성화입니다. 특히 혈액 응고에 관여하는 소화 효소 및 단백질은 이 메커니즘에 의해 조절됩니다. 그러나 단백질 분해는 돌이킬 수 없어서 환경 변화에 반응하여 단백질을 켜고 끄는 대신 효소 활성화를 제어하는 수단을 제공합니다.
대조적으로 다른 공유 결합 변형 , 특히 인산화 세포 내에서 쉽게 가역적이며 기능하며 아살로스테릭을 조절할 수 있습니다. 또한 환경 신호에 반응하여 다양한 세포 단백질을 가역적으로 활성화하거나 억제하는 단백질 인산화를 단백질 키나아제에 의해 촉매합니다.
대부분의 사람은 ATP에서 인산기를 전달하는 세린, 트레오닌 또는 타이로신 전기의 체인의 하이드록실기에 있습니다. 단백질 키나아제는 진핵생물에서 가장 큰 단백질 계열 중 하나이며 진핵 생물 유전자의 약 2%를 차지합니다. 대부분 단백질 키나아제는 세린과 트레오닌 또는 타이로신 전기를 인산화합니다.
이 효소는 각각 단백질, 세린, 트레오닌 키나아제 또는 단백질 '타이로신 키나아제'라고 합니다. 단백질 인산화는 인산화된 아미노산의 가수 분해를 촉매하는 단백질 포스파타아제에 의해 역전됩니다. 이 노산 잔기 단백질 키나아제와 마찬가지로 대부분 단백질 포스파타아제는 세린과 트레오닌 또는 타이로신 전기에 특이적이지만 일부 단백질 포스파타아제는 세 개의 포스포 아미노산을 모두 인식합니다.
단백질 키나아제와 단백질 포스 파타 제의 결합 작용은 많은 세포 단백질의 가역적인 인산화를 매개합니다. 종종 단백질 키나아제는 하나의 키나아제가 두 번째 키나아제를 활성화하는 신호 전달 경로의 성분으로 작용하며 이는 또 다른 키나아제에 작용할 수 있습니다.
일련의 단백질 키나아제의 지속적인 작용은 세포 표면에서 받은 신호를 세포 내 표적 단백질로 전달하여 환경 자극에 반응하여 세포 행동의 변화를 초래할 수 있습니다. 단백질 키나아제의 작용의 프로토타입은 Ed FisCHer에의 한 글리코겐 대사 연구에서 나온 1955년 Ed Krebs. 근육세포에서 호르몬 에피네프린(아드레날린)은 글리코겐토글루코스-1-인산의 분해를 신호하며, 근육 활동을 증가시키기 위해 사용 가능한 에너지원을 제공합니다.
글리코겐 분해는 단백질 키나아제에 의해 조절되는 효소 글리코겐 포스포릴리아제에 의해 촉매 됩니다. 에피네프린은 ATP의 고리형 AMP(CAMP)로의 전환을 유도하는 세포 표면 수용체에 결합하고, CAMP 의존성 단백질 키나아제라고 불리는 단백질 키나아제에 결합하여 활성화됩니다.
이 키나아제는 포스포릴 리아제 키나아제라고 불리는 두 번째 단백질 키나아제를 인산화하여 액티브를 절단합니다. 인산화 효소 키나아제는 글리코겐 포스포릴 리아제를 활성화해 포도당 생산을 유도합니다. 포스포릴리아제 키나아제와 글리코겐 포스포릴리아제 모두의 활성화된 인산화는 특정 포스파타아제에 의해 역전될 수 있기 때문에 초기 자극(에피네프린)의 제거는 더 이상의 글리코겐 분해를 억제합니다. 글리코겐 포스포릴 아제의 활성화를 유도하는 신호 전달 경로는 세포 표면에서 작은 분자의 결합으로 시작되는 수용체에 대한 에피네프린 결합과 CAMP 의존성 단백질 키나아제에 대한 CAMP 결합입니다.
다음 신호는 단백질 키나아제의 지속적인 작용으로 세포 내 표적으로 전달됩니다. 단백질 키나아제와 포스파타아제가 중심 역할을 하는 유사한 신호 전달 경로는 진핵 세포의 행동의 거의 모든 측면을 조절하는 데 관여합니다. 이러한 경로에서의 이상은 종종 단백질 키나아제의 이상과 함께 세포 증식 및 분화, 특히 암 발생의 부적절한 조절과 관련된 많은 질병에도 관여합니다. 인산화는 단백질 활성을 조절하는 가장 흔하고 가장 잘 연구되는 유형의 공유 결합 변형 반응이지만, 일부 다른 유형의 단백질 변형도 중요한 역할을 합니다.
여기에는 라이신 전기의 메틸화 및 아세틸화와 나이트로 실화 - 시스테인 전기의 체인에 NO 그룹의 첨가가 포함됩니다. 핵과 세포질 줄 단백질의 0- 결합 글리코실화도 조절 역할을 할 수 있습니다. ln 첨가, 일부 단백질은 유비퀴틴과 SUMO와 같은 작은 폴리펩타이드의 공유 결합으로 조절됩니다.
단백질 관련된 포스팅은 아래도 있으니 추가적으로 확인하길 바랍니다.
'면역 항암제' 카테고리의 다른 글
| 셀룰리스 개념 및 특징 (0) | 2020.07.03 |
|---|---|
| 세포간 결합 및 분리 이론 소개 (0) | 2020.07.03 |
| RSV 바이러스의 유래 및 개념 정리 (0) | 2020.06.30 |
| G1 세포의 특징 및 성장인자 소개 (0) | 2020.06.30 |
| Cdkl과 Cyclinbear 세포간의 관계 및 정의 (0) | 2020.06.30 |




